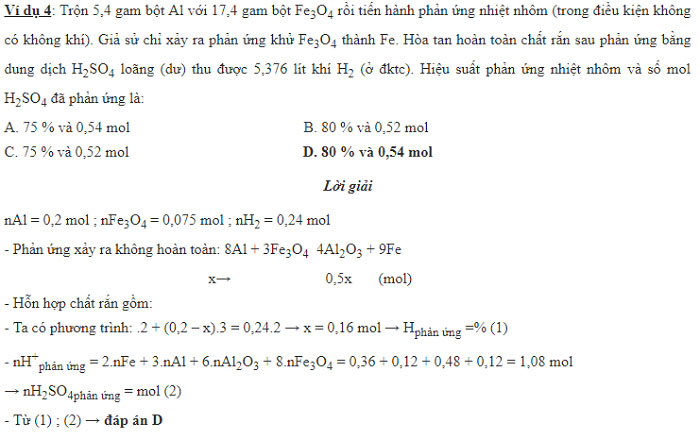Phản ứng về nhiệt nhôm được sử dụng để sản xuất hợp kim sắt và có nhiều ứng dụng trong cuộc sống. Vậy định nghĩa phản ứng nhiệt nhôm là gì? Hiệu suất của phản ứng nhiệt nhôm? Sản phẩm của phản ứng này là gì? Các dạng bài tập về phản ứng của nhiệt nhôm?.. Trong nội dung bài viết dưới đây, hãy cùng duytanuni.edu.vn khám phá về chủ đề này nhé!
Phản ứng nhiệt nhôm là gì?
Phản ứng nhiệt nhôm được định nghĩa là phản ứng hóa học tỏa nhiệt trong đó nhôm là chất khử ở trong nhiệt độ cao.
Phương trình tổng quát:
Al + oxit kim loại (overset{t^{circ}}{
ightarrow}) oxit nhôm + kim loại
(Hỗn hợp X) (Hỗn hợp Y)
Phản ứng này đã được sử dụng để khử oxit kim loại mà không dùng đến cacbon. Phản ứng này thường tỏa nhiệt rất cao, nhưng trong đó có một năng lượng hoạt hóa cao do các liên kết giữa các nguyên tử trong chất rắn phải được phá vỡ trước. Lúc này thì oxit kim loại được đun nóng với nhôm trong một lò đun. Phản ứng này chỉ có thể sử dụng để sản xuất ra số lượng nhỏ vật liệu.
Hans Goldschmidt đã cải tiến quy trình nhiệt nhôm (1893 – 1898), bằng cách đốt cháy hỗn hợp của bột oxit kim loại mịn và bột nhôm bằng một phản ứng khởi động trong đó đã không làm nóng hỗn hợp từ bên ngoài. Phương pháp này đã được cấp bằng sáng chế vào năm 1898 và được sử dụng rộng rãi trong các năm sau để hàn đường sắt. Các phản ứng này còn được ứng dụng để hàn đường sắt tại chỗ. Bởi vì điều này hữu ích cho việc cài đặt phức tạp hoặc sửa chữa tại chỗ khi không phải sử dụng cách hàn đường sắt liên.
Đang xem: Hiệu suất phản ứng nhiệt nhôm
Bên cạnh đó thì phản ứng này cũng được dùng để sản xuất phần lớn các hợp kim sắt, ví dụ như ferroniobium từ niobium pentoxide. Một số kim loại khác cũng đã được sản xuất theo phương pháp này.
Phản ứng nhiệt nhôm thường gặp
Ví dụ nổi bật nhất là phản ứng giữa oxit sắt III ((Fe_{2}O_{3})) và nhôm (Al):
(2Al+Fe_{2}O_{3}overset{t^{circ}}{
ightarrow}2Fe+Al_{2}O_{3})
Một số phản ứng khác như:
(8Al+3Mn_{3}0_{4} overset{t^{circ}}{
ightarrow}4 Al_{2}0_{3} + 9 Mn)
(Cr_{2}0_{3} + 2 Al overset{t^{circ}}{
ightarrow}Al_{2}0_{3} + 2 Cr)
Hiệu suất phản ứng nhiệt nhôm
Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm (Al) và (Cr_{2}O_{3}) trong điều kiện không có không khí. Sau một thời gian thu được 21,15 gam hỗn hợp X. Chia X thành hai phần bằng nhau. Cho phần 1 vào lượng dư dung dịch HCL nóng loãng, thu được 3,36 lít khí (H_{2}) (dktc). Hòa tan phần 2 vào lượng dư dung dịch NaOH đặc nóng, thu được 1,68 lít (H_{2}) (dktc). Biết các phản ứng của phần 1 và phần 2 đều xảy ra hoàn toàn. Hiệu suất của phản ứng là gì?
Cách giải:
Tính số mol chât của từng phần, khi đó (m_{X}=frac{21,95}{2})
Phần 2 với NaOH đặc nóng, chỉ có Al sinh ra khí (H_{2}), Cr không phản ứng.
(n_{Al}) dư (=frac{2n H_{2}}{3}=0,05)
Phần 1 với HCl, cả Al dư và Cr đều phản ứng sinh ra khí (H_{2})
(2nCr+3nAl =2nH_{2}
ightarrow nCr=0,075)
(2Al+Cr_{2}O_{3}
ightarrow Al_{2}O_{3}+2Cr)
(2Al+Cr_{2}O_{3}
ightarrow Al_{2}O_{3}+2Cr)
Vậy: (n_{Al}) ban đầu (=0,075+0,05=0,125)
và (n_{Cr_{2}O_{3}}) ban đầu (=frac{m_{X}-m_{Al}}{152}=0.05)
Hiệu suất phản ứng: (H=nCr_{2}O_{3}) pư/(nCr_{2}O_{3}) bđ (=75%)
Phản ứng nhiệt nhôm với (Cr_{2}0_{3})
Phương trình: (Cr_{2}0_{3} + 2 Al overset{t^{circ}}{
ightarrow}Al_{2}0_{3} + 2 Cr)
Phản ứng nhiệt nhôm với (Cr_{2}0_{3}) lần đầu tiên được sử dụng để khử oxit kim loại mà không sử dụng cacbon. Phản ứng này tỏa nhiệt rất cao: 2200 °C, nhưng nó có một năng lượng hoạt hóa cao do các liên kết giữa các nguyên tử trong chất rắn phải được phá vỡ trước.
Sản phẩm của phản ứng nhiệt nhôm luôn có gì?
(A. Al(OH)_{3})
(B. O_{2})
(C. Al)
(D. Al_{2}O_{3})
Đáp án: D
Các trường hợp phản ứng nhiệt nhôm xảy ra
Phản ứng xảy ra hoàn toàn
Nếu phản ứng xảy ra hoàn toàn, tùy theo tính chất hỗn hợp Y tạo thành để biện luận. Ví dụ:
Hỗn hợp Y chứa 2 kim loại (
ightarrow) Al dư, oxit kim loại hết.Hỗn hợp Y tác dụng với dung dịch bazơ kiềm (NaOH,…) giải phóng (H_{2}
ightarrow) có Al dư.Hỗn hợp Y tác dụng với dung dịch axit có khí bay ra thì có khả năng hỗn hợp Y chứa ((Al_{2}O_{3}+Fe)) hoặc ((Al_{2}O_{3}+Fe+Al)) hoặc ((Al_{2}O_{3}+Fe)) + oxit kim loại dư.
Phản ứng xảy ra không hoàn toàn
Nếu phản ứng xảy ra không hoàn toàn, hỗn hợp Y gồm (Al_{2}O_{3}, Fe, Al dư) và (Fe_{2}O_{3}) dư.
Xem thêm: Cách Giả Lập Ios Trên Pc Hướng Dẫn Sử Dụng Và Cài Đặt, 9 Phần Mềm Giả Lập Ios Trên Pc Tốt Nhất 2021
Định luật liên quan phản ứng nhiệt nhôm
Định luật bảo toàn khối lượng: (m_{hhX}=m_{hhY})ĐỊnh luật bảo toàn nguyên tố (mol nguyên tử): (n_{FeX}=n_{FeY};n_{AlX}=n_{AlY}).
Bài tập về phản ứng nhiệt nhôm
Nếu phản ứng xảy ra hoàn toàn
Thường là do không biết số mol Al và (Cr_{2}O_{3}) là bao nhiêu nên phải xét đủ 3 trường hợp rồi tìm nghiệm hợp lý:
Trường hợp 1: (Al ) và (Cr_{2}O_{3}) dùng vừa đủ:
(2Al+Fe_{2}O_{3}overset{t^{circ}}{
ightarrow}2Fe+Al_{2}O_{3})
(a
ightarrow frac{a}{2}
ightarrow frac{a}{2}
ightarrow a)
Suy ra hỗn hợp sau phản ứng: Fe: a mol; (Al_{2}O_{3}:frac{a}{2}) mol.
Trường hợp 2: Al dùng dư: (2Al+Fe_{2}O_{3}overset{t^{circ}}{
ightarrow}Al_{2}O_{3}+2Fe)
(2b
ightarrow b
ightarrow b
ightarrow 2b)
Suy ra: Hỗn hợp sau phản ứng:
Fe: 2b mol; (Al_{2}O_{3}:b) mol; (Al_{dd}: (a-2b)) mol.
Trường hợp 3: (Fe_{2}O_{3}) dùng dư:
(2Al+Fe_{2}O_{3}overset{t^{circ}}{
ightarrow}Al_{2}O_{3}+2Fe)
(a
ightarrow frac{a}{2}
ightarrow frac{a}{2}
ightarrow a)
Suy ra hỗn hợp sau phản ứng: Fe: a mol; (Al_{2}O_{3}:frac{a}{2}) mol, (Fe_{2}O_{3}: (b-frac{a}{2})).
Nếu phản ứng xảy ra không hoàn toàn
Gọi x là số mol (Fe_{2}O_{3}) tham gia phản ứng
(2Al+Fe_{2}O_{3}overset{t^{circ}}{
ightarrow}Al_{2}O_{3}+2Fe)
(2x
ightarrow x
ightarrow x
ightarrow 2x)
Suy ra: Hỗn hợp sau phản ứng:
Fe: 2x mol; (Al_{2}O_{3}:x) mol; (Fe_{2}O_{3}) dư (b-x) mol; Al dư: (a-2x) mol.
Xem thêm: Cách Làm Thẻ Tín Dụng Sacombank: Điều Kiện Mở Thẻ Tín Dụng Sacombank Đầy Đủ Nhất
Lưu ý: Nếu bài yêu cầu tính hiệu suất phản ứng ta giải trường hợp phản ứng xảy ra không hoàn toàn.
Một số ví dụ về phản ứng nhiệt nhôm
Như vậy, bài viết trên đây của duytanuni.edu.vn đã giúp bạn tổng hợp các kiến thức về phản ứng nhiệt nhôm. Hy vọng những kiến thức trên sẽ hữu ích với bạn trong quá trình học tập. Chúc bạn luôn học tốt!
Xem chi tiết qua video: